気の遠くなるような医薬品の研究成功確率
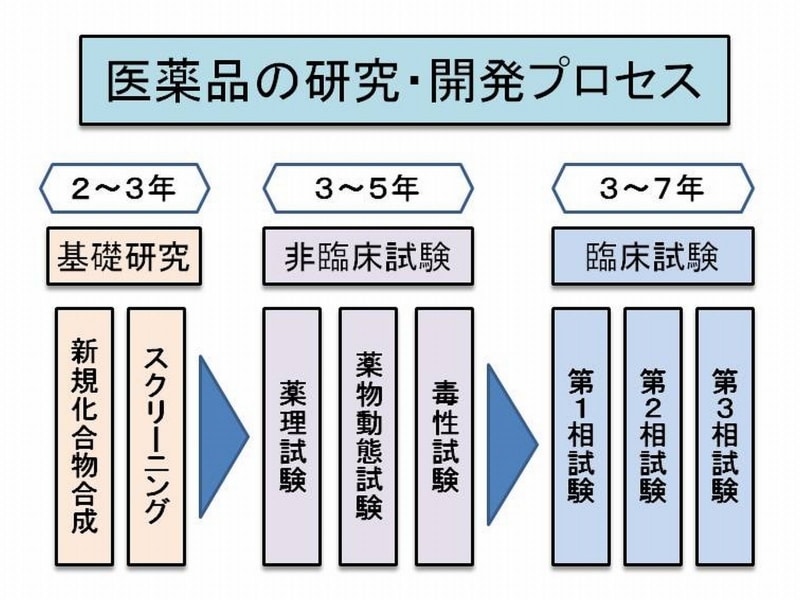
薬づくりは、病気の治療に効果のある成分(化合物)を発見したり創り出したりすることから始まります。この段階で研究対象となる化合物はどれくらいあると思います?日本製薬工業協会の調べでは、日本の製薬企業17社が1992年からの5年間で見つけたり合成した化合物は320,832件だったそうです。そのなかから薬として世の中に送り出されたのはわずか53件(6,000分の1の確率!)だったといいますから、気の遠くなるような話ですね。動物を使った有効性と安全性の試験(非臨床試験)
こうした膨大な研究対象物質のなかから、薬としての効果が期待できて毒性が少ない物質が次の開発段階へと進みます。開発段階では先ず動物や細胞を使って医薬品としての有効性と安全性を確認します(非臨床試験)。薬の効き目を調べる「薬理試験」、体内でどのように吸収・分布・代謝・排泄されるかを調べる「薬物動態試験」、そして様々な毒性を調べる「毒性試験」が行われます。この非臨床試験はGLPと呼ばれる厳しい基準に則って実施され、通常は3~5年かかります(GLP:Good Laboratory Practice:医薬品の安全性に関する非臨床試験の実施の基準)。人を対象にした有効性と安全性の試験(臨床試験)
非臨床試験をパスした薬の候補化合物(治験薬)が、人間に対して有効で安全かを調べるのが臨床試験(治験)。臨床試験は3段階で行われます。最初に行われるのが第1相試験。少数の健康な人を対象に副作用などの安全性を確認します。次に少数の患者を対象に有効で安全な投薬量や投薬方法などを確認するのが第2相試験。そして最後に、多数の患者を対象に有効性と安全性について既存薬などとの比較を行います(第3相試験)。臨床試験にもGCPという厳しい実施基準が設けられていて、3~8年かかります。(GCP:Good Clinical Practice:医薬品の臨床試験の実施の基準)膨大な時間と費用を要する研究開発とライセンシング
こうした基礎研究から臨床試験までには8~15年の歳月がかかります。しかもその過程で大半は薬の候補から消えていきます。そのため製薬企業では、自社で研究・開発してきた化合物だけでは安定的に新しい薬を開発し続けられないおそれがあります。そこでバイオベンチャーなどから有望な化合物に対する開発権を有償で譲り受けることによって、自社の開発品目(開発パイプライン)を補うようになってきました(ライセンシング)。製薬企業は開発権を購入すること(ライセンスイン)によって開発パイプラインを補充できますが、バイオベンチャーはせっかくの有望な化合物をなぜ自分たちで最後まで開発せずに途中で譲渡(ライセンスアウト)してしまうのでしょうか。
新しい薬を完成させるためには150億円とも200億円とも言われる巨額の資金が必要です。特に臨床試験段階が最もお金がかかります。また基礎研究段階や非臨床試験段階では有望な化合物でも、臨床試験段階で有効性や安全性に問題が見つかるリスクもあります。そのためバイオベンチャーにとっても、自社で臨床試験まで続けるよりも開発権をライセンスアウトした方がよいと判断する場合があります。また自社で開発する資金を賄うために国や地域(ヨーロッパ、アジアなど)を限定して開発権を譲渡し、その資金を使って残りの国や地域で自社開発する場合もあります。
自社で開発を行うにしても他社からライセンスインを受けるにしても、資金力が製薬企業の命運を分ける時代となっています。MRとして転職先の製薬企業を検討する上でも、資金力は重要な判断要素といえます。